04 扮演上帝:订制DNA分子
04-12Ctrl+D 收藏本站

超级安全的P4实验室,专供针对致命病毒!例如伊波拉病毒)或发展生物武器等进行生化研究之用。在20世纪70年代晚期,要用遗传工程方法来研究人类DNA的科学家也必须使用P4级实验室。
DNA分子非常长,任何一条染色体内都只有一个连续的DNA双螺旋分子。一些评论家很爱把双螺旋跟纽约市电话簿的数据数目或多瑙河的长度相比,好让人了解这些分子有多庞大。但这帮不上我的忙,因为我对纽约市有多少电话号码毫无概念,而提到多瑙河只会让我想起斯特劳斯的圆舞曲,不会想到任何线性长度。
除了性染色体X与Y以外,人类染色体都是根据大小来编号。1号染色体最大,21号和22号染色体最小。在每个细胞的总DNA量中,有8%位于1号染色体内,大约有2.5亿对碱基。21号和22号染色体则分别有4000万和4500万对碱基。即使是最小的DNA分子,例如微小病毒的DNA分子,至少也含数千对碱基。
DNA分子太过庞大,是早期分子生物学上的一大难题。为了掌握特定的基因(即特定的一段DNA),我们必须设法从朝两端不规则延伸的极长DNA分子中,把这段DNA分离出来。不仅如此,我们还得设法把它“放大”,才能取得足够研究使用的样本。这也就是说,我们需要一个分子编辑系统:要有一把分子剪刀,能将DNA剪成容易处理的片段;再来要有一罐分子胶水,以便操纵这些片段;最后还需要一个分子复印机,以便将剪下和分离的片段放大。这相当于今日的文书处理器功能:剪下、贴上和复制(cut、paste、copy)。
即使在破解遗传密码后,要发展出能执行这些程序的基本工具,似乎仍遥不可及。然而,20世纪60年代晚期和70年代初期的一些发现,却在1973年巧妙地整合,形成所谓的“重组DNA”(recombinant DNA)技术,亦即编辑DNA的能力。这不只是一般实验技术的精进而已,科学家似乎在朝夕间具备了调整DNA分子的能力,能够创造出自然界前所未见的分子。我们可以借由操控支撑所有生命的分子,来“扮演上帝”。许多人觉得这种想法令人不安。恐惧科技的美国著名作家里夫金(Jeremy Rifkin)就担忧地认为,每一个新遗传技术都像是一个“科学怪物”,不过他所谓重组DNA“重要性可与火的发现相比美”的说法,倒是相当贴切。
科恩伯格是首位在试管里“创造生命”的人。如前所述,他在20世纪50年代发现DNA聚合酶,这种酶通过从两股业已分开的亲代股形成互补股的方式来复制DNA。后来他专心研究某种病毒DNA,最终得以用这种酶复制出病毒DNA全部的5300对碱基。但这个产物不是“活的”;虽然它的DNA序列跟亲代一样,却不具生物活性。这当中还缺乏某种神秘物质。直到1967年,美国国家卫生研究院的盖烈特(Martin Gellert)和斯坦福大学的莱曼(Bob Lehman)才同时找到它:一种被命名为连接酶(ligase)的酶,它能把DNA分子的两个末端“黏”起来。
科恩伯格利用DNA聚合酶来复制病毒DNA,并且借由加入连接酶,使DNA的两个衣端相连,让整个分子形成一个连续环,如同原本的病毒。这个“人工”病毒DNA的行为就跟自然的病毒DNA一模一样。这种病毒通常在大肠杆菌里繁植,而科恩伯格在试管里制造出的DNA分子也一样。他只用两个酶、一些基本的化学成分和用来制造复本的病毒DNA,就创造出具有生物作用的分子。媒体报道说,他在试管中创造出生命,约翰逊总统还因而将这个突破称为“惊人的成就”。
在20世纪60年代,瑞士生化学家埃布尔(Wemer Arber)对发展重组DNA技术的贡献,则比较出人意表。埃布尔的兴趣不在于研究像生命的分子基础这类大问题,而在于病毒自然史上的一个疑点。他研究一些病毒DNA在侵入细菌宿主细胞后被分解的过程。有些宿主细胞会把特定的病毒DNA视为外来物质,选择性地攻击它们,但不是所有的宿主细胞都如此(否则病毒将无法繁殖)。这过程是如何发生的?原因何在?无论是在细菌、病毒、植物或动物身上,自然界所有的DNA都是相同的基本分子。细菌在攻击病毒的DNA时,为什么不会攻击自己的DNA?埃布尔找到的第一个答案是一群能降解DNA的酶,称为“限制酶”(restriction enzyme)。由于限制酶会切断外来的DNA,因此只要细菌细胞内有它们的存在,就可以限制病毒的生长。这种切断DNA的作用是针对特殊序列所产生的反应:特定的限制酶只有在认出某个特别序列时,才会切断DNA。例如首批被发现的限制酶之一EcoRl,就会辨识和切断碱基序列GAATTC。
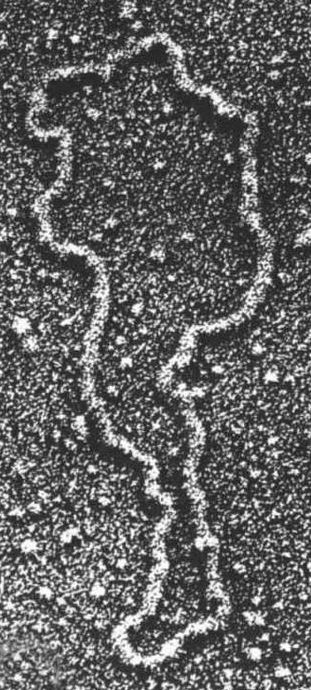
电子显微镜下的质体。
但是为什么细菌不会切断自己DNA的GAATTC序列?这正是埃布尔的第二大发现。在制造以特定序列为目标的限制酶时,细菌也会制造第二种酶,它能以化学方式——在碱基中加入甲基团CH3——来修饰本身DNA上任何位置的相同序列。因此当限制酶EcoRl大肆破坏病毒DNA的GAATTC序列时,在细菌DNA中经过修饰的GAATTC序列就不会被认出来。
重组DNA革命的下一个大进展,来自细菌的抗药性研究。在20世纪60年代科学家已经发现,许多细菌不是按照标准方式(通过细菌基因组的突变)对某一种抗生素产生抗药性,而是经由引入外来的DNA片段来产生抗药性,这种DNA片段称为质体(plasmid)。质体是独立于细菌染色体以外的小段环状DNA,在细胞分裂期间,跟细菌基因组的其他成分一起复制和传递。在特定情况下,质体也可以在细菌之间互相传递,让接收者能快速获得“出生”时所没接收到的完整遗传信息。这些信息通常包含能带来抵御抗生素能力的基因。抗生素所造成的自然选择有利于那些具有抵抗因子(质体)的细菌细胞。
斯坦福大学的柯恩(Stanley Cohen)是研究质体的先驱。他在高中生物老师的鼓励下,朝医学领域发展。他刚从医学院毕业时,原本打算当内科医生,后来因为不想被征去当军医,就接受了国家卫生研究院的研究职位。他很快就发现自己喜欢研究胜于行医。1971年,他有了重大突破,设计出一种能诱导大肠杆菌细胞自细胞外引入质体的方法。事实上柯恩等于让大肠杆菌“变形”,如同40年前格里菲斯通过摄入(uptake) DNA,把不会致命的肺炎菌株变成会致命的菌株。不过,柯恩的研究是把含有抗药性基因的质体,注入先前对抗生素没有抵抗力的菌株内。这个菌株所产生的后代就会对抗生素具有抗药性,并且在每次细胞分裂期间,都将质体DNA原封不动地传给下一代。

遗传工程先驱波耶(左)与柯恩。
波耶跟柯恩一样,也是学过双蠓旋的新一代科学家。他对研究DNA充满热情,甚至把自己养的一对暹罗猫命名为沃森和克里克。他在大学毕业后会进入细菌遗传学的研究领域,没人感到惊讶,他的教练更觉得这是理所当然的事。
到了20世纪70年代初期,制造“重组DNA”的所有成分都已齐备。首先,我们利用限制酶切断DNA,分离出想要的基因序列;然后利用连接酶把这个序列“贴到”质体内(这时质体就像一张磁盘,内含我们想要的序列);最后只要把这张“质体磁盘”插入细菌细胞,就可以复制我们所要的DNA片段。细菌细胞分裂时会像复制本身的遗传物质一样,也复制含有我们所要的DNA片段的质体。因此,只要把一个质体植入单一细菌细胞内,细菌在繁殖时就可制造出大量我们所选择的DNA序列。只要让这个细胞不断繁殖,最终就可形成由数十亿个细菌构成的庞大菌落,创造出数十亿个我们想要的DNA复本。这个菌落成了我们的DNA工厂。
1972年11月,剪下、贴上和复制这三个要素终于在夏威夷一场讨论质体的会议上会合。当时刚在加州大学洛杉矶分校获得永久教职的年轻教授波耶(Herb Boyer)出席了那场会议,质体先驱柯恩自然也在场。波耶跟柯恩一样来自美国东岸,他在宾州西部念高中时担任过美式足球校队的前锋,他很幸运,因为球队教练正好是他的科学老师。
虽然波耶和柯恩当时都在旧金山湾区工作,但在夏威夷那场会议前,两人一直没碰过面。在那个限制酶鲜为人知的年代,波耶却已是这个领域的专家,他和同事刚找出EcoRl酶切割地点的序列。波耶和柯恩很快就发现,结合他们俩的专长之后,可以将分子生物学带往崭新的境界,也就是剪贴和复制的世界。有天晚上,他们在威基基(Waikiki)附近一家小吃店开始梦想重组DNA技术的诞生,还把构想写在餐巾纸上。他们充满远见的未来大计后来被喻为“从腌牛肉迈向克隆”。
数月后,波耶在旧金山的实验室开始跟往南40英里、柯恩位于帕洛阿尔托(Palo Alto)的实验室合作。波耶负责的自然是限制酶研究,而柯恩则负责质体程序。幸好当时柯恩的实验室有一位技术员安妮·张(Annie Chang)就住在旧金山,所以能往返两地,运送珍贵的实验物品。他们的第一个实验是以制造混合体为目标,也就是把两种能让宿主对特定抗生素产生抗药性的质体,混合成所谓的“重组体”。其中一个质体上的基因(即DNA片段)可以抵抗四环素(tetracycline),另一个质体上的基因可以抵抗卡那霉素(kanamycin)。(最初的结果如同预期,携有第一种质体的细菌被卡那霉素杀死,而携有第二种质体的细菌则被四环素杀死。)这个实验的目标,是要创造出能使宿主对两种抗生素都产生抗药性的“超级质体”(super-plasmid)。
首先,他们用限制酶把这两种质体分别切断,接着把它们混合置入同一个试管并加入连接酶,让被切断的末端相连。就这个混合物的一些分子而言,连接酶只是使被切断的质体恢复原状,亦即它们只是把相同质体的两端连接起来。但有时连接酶会连接不同质体的DNA片段,从而产生想要的混合体。在完成前述步骤后,下一步是用柯恩的质体输入(plasmid-importing)技巧,把所有的质体移植到细菌里,再把培养出来的菌群放到涂了四环素和卡那霉素的培养皿上。恢复原状的质体仍只会让细菌对其中一种抗生素产生抗药性,因此这些细菌在有两种抗生素的环境里无法存活。惟有具有重组质体的细菌才能生存:因为这种质体是由两种DNA重组而成,一种DNA编码可以抵抗四环素,另一种可以抵抗卡那霉素。
下一个挑战是从截然不同的生物体上取出DNA(例如人类DNA),然后制造混合质体。早期有个实验成功地把非洲爪蟾(African clawed toad)的基因植入大肠杆菌的质体,再把这个质体植入细菌内。每次细菌群落的细胞分裂时,都会复制那段插入的爪蟾DNA。以容易令人混淆的分子生物学词汇来说,我们“克隆”(clone) 了爪蟾的DNA。后来证明哺乳动物的DNA也可以克隆。回想起来,其实这不足为奇。无论来源为何,DNA片段毕竟仍是DNA,化学性质仍然相同。大家很快就发现,柯恩和波耶复制质体DNA片段的做法,显然适用于取自任何生物的DNA。
了爪蟾的DNA。后来证明哺乳动物的DNA也可以克隆。回想起来,其实这不足为奇。无论来源为何,DNA片段毕竟仍是DNA,化学性质仍然相同。大家很快就发现,柯恩和波耶复制质体DNA片段的做法,显然适用于取自任何生物的DNA。

重组DNA分子
分子生物学革命的第二阶段于是展开。在第一阶段,我们的目的在于描述DNA在细胞内的运作;现在,有了重组DNA 之后,我们等于拥有了干预和操控DNA的工具。我们可以看见“扮演上帝”的机会正快速地发展,前景可观。这种得以钻研生命奥秘的庞大潜力,以及在对抗癌症等疾病上获得实质进展的机会,令人相当兴奋。但是柯恩和波耶在大幅拓展了我们的科学视野之际,是否也开启了潘多拉的宝盒?分子克隆是否潜藏着未知的危险?我们能否继续兴高采烈地把人类的DNA片段植入大肠杆菌?大肠杆菌在人类肠道的微生物丛林中是占优势的物种,万一这些被改变的生命形态潜入人体的话,怎么办?简单地说,在一些人担忧地呐喊“这就像在制造细菌版的科学怪物”时,我们能否心安理得地充耳不闻?
之后,我们等于拥有了干预和操控DNA的工具。我们可以看见“扮演上帝”的机会正快速地发展,前景可观。这种得以钻研生命奥秘的庞大潜力,以及在对抗癌症等疾病上获得实质进展的机会,令人相当兴奋。但是柯恩和波耶在大幅拓展了我们的科学视野之际,是否也开启了潘多拉的宝盒?分子克隆是否潜藏着未知的危险?我们能否继续兴高采烈地把人类的DNA片段植入大肠杆菌?大肠杆菌在人类肠道的微生物丛林中是占优势的物种,万一这些被改变的生命形态潜入人体的话,怎么办?简单地说,在一些人担忧地呐喊“这就像在制造细菌版的科学怪物”时,我们能否心安理得地充耳不闻?

重组DNA:克隆一个基因。
1961年,科学家从用于调配小儿麻痹疫苗的恒河猴肾脏中,分离出一种称为SV40的猿猴病毒(SV为simian virus的首字母)。这种病毒自然存在于猿猴体内,虽然一般认为它对这些猴子没有影响,但实验很快证明,它可能导致啮齿动物罹患癌症,在特定的实验条件下,甚至可能在人类细胞中引起癌症。由于小儿麻痹疫苗接种计划自1955年实施以来,已经让数百万名美国儿童感染这种病毒,因此这项发现着实令人心惊。小儿麻痹防治计划是否无意间造成一整个世代的人罹患癌症?幸好,答案似乎是否定的:SV40并未造成任何癌症的流行,而且它对人类似乎就跟对猿猴一样无害。然而,尽管SV40已成为分子生物实验室的常客,但许多人对它是否安全仍存有疑虑。我对这件事特别关心,因为那时我已是冷泉港实验室的主任,在我们的实验室里,有愈来愈多年轻科学家正在研究SV40,想找出癌症的遗传基础。
在此同时,斯坦福大学医学院的博格(Paul Berg)对这件事的前景大感振奋,反倒不在意SV40的威胁,他预料在未来可以利用这种病毒,把DNA片段(外来基因)引入哺乳动物的细胞。这种病毒可以成为哺乳动物体内的分子运输系统,一如柯恩用质体在细菌体内所做的。但柯恩主要是把细菌当作复印机,用以放大DNA的某个特定片段;但在博格的眼中,SV40是把矫正基因引入遗传疾病患者体内的方法。博格超越了他的时代,他想要做的正是今日所谓的基因治疗:把新的遗传物质引入病患体内,弥补先天遗传得到的基因缺陷。

SV40轿车:博格和他以病毒命名的本田(Honda)车。
博格在1959年到斯坦福大学担任初级教授,这是名望比他高的科恩伯格从圣路易市的华盛顿大学被延揽到斯坦福时就与学校说好的条件之一。其实博格和科恩伯格的渊源甚早,他们都出生于纽约的布鲁克林区,也都参加过由伍尔夫(Sophie Wolfe)老师指导的高中科学社团。博格曾经回忆说:“她让科学变得有趣,也让我们分享想法。”其实这说法太过含蓄,伍尔夫在埃布尔拉罕林肯高中带领的社团出了三位诺贝尔奖得主,分别是科恩伯格(1959)、博格(1980)和结晶学家卡利(Jerome Karle,1985)。他们全都曾公开推崇她对自己的影响。
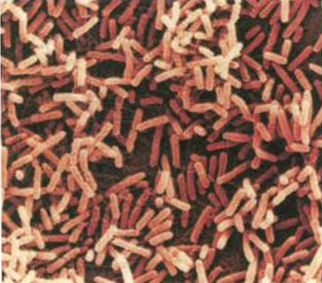
肠道微生物大肠杆菌:如果你愿意去检视的话,在每一克的人类粪便中,可以找到大约1000万个大肠杆菌。
1971年夏天,在冷泉港实验室,博格的一位研究生就这项实验计划提出报告。列席的一位科学家听完后忧心不已,立即致电博格。他问博格说,万一事情刚好朝相反方向发展怎么办?换句话说,万一SV40病毒不但没有接纳这个病毒DNA并把它插入动物细胞,反而被噬菌体DNA操控,造成SV40DNA被插入大肠杆菌等细菌细胞的话,怎么办?这并非不切实际的假设。毕竟,把自己的DNA插入细菌细胞,正是许多噬菌体的“天赋使命”。由于大肠杆菌无所不在,与人类的关系亲近,又是人类肠道中的主要成员,博格原本立意良善的实验,有可能制造出危险的,携带可能致癌的SV40猿猴病毒的大肠杆菌菌落。虽然博格并不忧心,但仍接受了这位科学家的看法,他把这个实验延后,等到对SV40的致癌潜力有进一步的了解后再说。
正当柯恩和波耶,以及此时也投入这领域的其他人,正努力解开剪贴DNA分子的细节时,博格已规划了一个相当大胆的实验:他想看看植入外来DNA片段的SV40,是否能将那段外来基因输送至动物细胞内。为了方便起见,他从现成可用的细菌病毒(即噬菌体),取得要植入SV40的外来DNA,再来检视包含SV40DNA和噬菌体DNA的合成分子是否能成功地入侵动物细胞。如果这个分子跟博格希望的一样,真能入侵动物细胞,就代表他有机会利用这个系统,把有用的基因植入人类细胞。
在波耶和柯恩成功地完成重组DNA实验的消息曝光后,各界对生物危害(biohazard)的疑虑便接踵而至。1973年夏天,在新罕布什尔州举行的有关核酸的科学会议上,大多数人投票赞成请美国国家科学院(National Academy of Sciences, NAS)立即调查这项新科技的危险性。一年后,由国家科学院成立并由博格担任主席的委员会,在写给《科学》(Sciences)杂志的信上公布调查结论。我本人和其他许多科学家,包括在相关研究上最为积极的柯恩和波耶在内都签署了这封信。在这封“暂停信”(Moratorium Letter)上,我们呼吁“世界各地的科学家”自动自发地暂缓所有关于重组的研究,“直到这类重组DNA分子的潜在危险经过更妥善的评估,或直到有足够的方法能防止它们扩散为止”。这项声明的重点在于承认“我们的关切是基于对潜在可能的判断,而不是基于已经证实的风险,因为在目前,与这类DNA分子的危险性有关的实验数据极少”。
然而,在联合署名后,我立即沮丧起来,后悔在这封“暂停信”上签名。分子克隆显然具有可以为这个世界带来许多益处的潜力,如今,在历经辛苦的研究,而且生物学的大革命就在眼前之际,我们却一致决定退却。这情况令人手足无措。罗杰斯(Michael Rogers)在1975年为《滚石》杂志(Rolling Stone)所写的专题报道中指出:“分子生物学家在做这类实验时面临的危机,最终可能跟核物理学家在发明原子弹前几年的情况相同。”我们究竟是谨慎,还是怯懦?当时我无法确定,似是心里已经隐隐觉得,答案可能是后者。
1975年2月,在加州海边小镇帕西菲克格罗夫市(Pacific Grove)的爱希勒玛(Asilomar)会议中心举办了一场会议,一共有140位来自全球各地的科学家出席。罗杰斯把这场会议叫做“潘多拉宝盒大会”(Pandora's Box Congress)。它的目的是要一劳永逸地决定,重组DNA可能带来的危害是否真的比好处多。我们是否要将暂缓改为永远不得进行?是要不顾一切潜在的危险,奋勇前进,还是要等发展出明确的保护措施后再说?身为大会筹备委员会的主席,博格也是这场会议的名誉主持人,必须设法在会议结束前制定出一致的声明,但这几乎是不可能的任务。
在英国剑桥作研究的布雷纳提供了一份相关数据,这类数据当时极为少见。他收集了一种大肠杆菌的菌落,对于分子克隆研究来说,这种称为K-12的大肠杆菌是最佳的实验品。有些罕见的大肠杆菌菌种偶尔会引起食物中毒,但是绝大多数大肠杆菌菌种是无害的,布雷纳假设K-12也不例外。他关心的不是自己的健康,而是K-12的“健康”:K-12在实验室外是否能生存?他把这种病菌加入牛奶里(因为直接喝不太好喝),一口气把这可怕的饮料喝光。然后他监测自己的排泄物,看是否有任何K-12细胞在他的肠道内繁殖。结果他没找到任何K-12细胞,显然K-12尽管可以在培养皿里繁殖,但在“自然”世界却无法生存。然而还是有人对这个推论表示质疑:即使K-12本身无法生存,这并不能证明它们不能和其他能在人类肠道内生存的菌种交换质体(或其他的遗传信息)。因此,经过“改造”的基因仍有可能进入肠道细菌的族群中。布雷纳主张我们应该培养绝对无法在实验室外生存的K-12菌种。我们可以通过基因改造,确保这个菌种只有在提供特殊养分时,才能生长。当然,我们可以列出一些永远无法从自然界获得的养分,而且这些养分惟有在实验室里才有可能全部同时存在。因此,被改造过的K-12将会是“安全的”细菌,只能在我们控制的研究环境中生存,但真实世界注定要死亡。
在布雷纳的推动下,这个折中的提案终于通过。当然,两种最极端意见的支持者都有许多不满,但这场会议最终仍达成了一致的建议,允许科学家继续研究已经丧失功能、不会致病的细菌,并强制要求在进行涉及哺乳动物DNA的研究时,必须使用昂贵的防范设备。这些建议后来发展成一整套方针,并在一年后由美国国家卫生研究院公布。
我灰心地离开会场,自觉与大多数同事格格不入。柯恩和波耶也很沮丧,他们跟我一样认为,身为科学家应具有良好判断力,许多同事却自动缴械,只为了被媒体视为“好人”,而非潜在的“科学怪人”(Dr. Frankenstein)。事实上,绝大多数的人都没有处理过致病生物,并不了解这些限制对我们研究这类生物的人所造成的影响。许多武断的决定让我感到很恼怒。例如,冷血脊推动物的DNA可以研究,但哺乳动物的DNA却是大多数科学家的禁区;显然研究蟾蜍的DNA是安全的,但研究老鼠的DNA则否。我认为这种愚昧的想法简直不可思议,便“以毒攻毒”地指出:难道大家不知道蟾蜍会让人长疣吗?但我这种戏谑的反对徒劳无功。

DNA大辩论:1975年爱希勒玛会议期间,(左起)辛格(Maxine Singer)、津德(Norton Zinder)、布雷纳和博格设法解决重组DNA所引起的问题。辛格和津德也都是美国生化和遗传学界的翘楚。
那场会议有媒体在场,一头雾水地听着科学家交换最新的术语。律师也在场,提醒我们别忘了这当中有一些法律问题需要解决。例如,假设我的一位技术人员得了癌症,我身为重组研究实验室的主任,是否要负法律责任?科学家由于天性和训练使然,不愿意在缺乏相关知识的情况下随便预测。大家本就怀疑这场会议根本不可能达成一致的决定。或许博格也同样感到怀疑。无论如何,他选择让与会者自由发言,而不是以主席身份强势领导。结果这场会议变成一场自由讨论,不时有人漫无边际地讲些不相干的事,冗长地说明自己的实验室所进行的重要研究。从怯懦的“继续禁止”到狂热的“禁止什么,科学要继续发展才行”,各种意见杂陈,而我当然是支持后者。当时我认为,只因为未知和尚未量化的危险就延后研究,是更不负责任的做法。世上有许多人因癌症或纤维囊泡症(cystic fibrosis)病入膏肓,这或许是他们惟一的希望,我们有什么权利拒绝他们?
这些方针让许多参加爱希勒玛会议的人以为,从此可以畅通无阻地进行以克隆“安全细菌”为主的研究。但凡是在这种想法下进行研究的人,很快就发觉困难重重。根据大众媒体所散播的逻辑,如果连科学家都认为有值得担心之处,一般社会大众自然更应该感到忧惧。当时美国正值“反文化”(counterculture)的年代,尽管这股反传统的浪潮已开始式微,但毕竟尚未完全消失。越战和尼克松的政治生涯才刚结束,多疑的社会大众根本无力了解科学家本身也才刚开始研究的复杂事物,他们只是一股脑儿采信所谓领导阶层在酝酿邪恶阴谋的理论。至于我们科学家则相当惊讶地发现自己被归类为统治阶层,尽管我们从没想过自己属于这个阶层。波耶是名副其实的嬉皮科学家,但是就连他也在旧金山湾区地下报纸《柏克莱毒舌报》(Berkeley Barb)的万圣节特刊中,发现自己名列湾区“十大妖怪”之一,以前只有贪污的政客和跟工会作对的资本家才会上榜。
我最害怕的是,社会大众对分子生物学炽烈的偏执恐惧,会导致严苛的法律。以繁杂难懂的法律文字来规范可做和不可做的实验,只会对科学造成伤害。实验计划必须呈交给政治导向的审查小组,无可救药的官僚制度,会像老祖母衣橱里的蛀虫一样难以摆脱。同时,我们在尽最大努力评估研究工作真正的风险时,却因完全缺乏数据而难以定论,在逻辑上也很难证明绝无风险。虽然重组DNA技术从没造成过任何灾难,媒体却老爱想像“最坏的情况”。在谈到1977年华盛顿的一场会议时,生化学家赫佩尔(Leon Heppel)巧妙地总结了科学家在这场争论中感受到的荒谬:
这种感觉就像被选入西班牙政府召集的特别委员会,评估哥伦布和他的水手将承受的风险。这个委员会要制定出一套方针,看万一发现地球是平的的时候该怎么做,以及水手可以朝地球边缘安全地前进多远等等。
然而,即使这些讥讽的言词,也无法阻止那些态度坚决的人反击他们眼中如同普罗米修斯般傲慢的科学家。马萨诸塞州坎布里奇市市长维路奇(Alfred Vellucci)就是发起这类反对“圣战”的人之一。维路奇靠捍卫小市民的形象而赢得政治声名,但这次却是以城里顶尖的教育机构,亦即麻省理工学院和哈佛为代价。重组DNA风暴提供了他最佳的政治作秀机会。那时一篇报道生动地描绘了当时的情况:
一身暗红色的双针织夹克和黑长裤,几乎掩不住啤酒肚的黄条纹蓝衬衫,再加上歪斜的牙齿和塞得鼓鼓的口袋,维路奇代表了一般美国人对科学家、科技官僚和自以为聪明的哈佛书呆子所感受到的无奈。他们认为这些人自以为可以操纵世界,结果却留下一堆烂摊子。而要面对这些烂摊子的人是谁?不是那些书呆子。最后得自力救济,清理这堆烂摊子的人总是维路奇和一般的劳动大众。
情况为什么会演变得如此激烈?哈佛的科学家曾建议在校内兴建防护设施,在严格遵守国家卫生研究院的新规定下,进行重组DNA研究。维路奇逮到机会,再加上哈佛和麻省理工的左翼组织基于本身反DNA的主张而支持他,他设法在坎布里奇市通过一项长达数月的禁令,禁止进行所有的重组DNA研究。结果在短时间内造成当地人才明显流失,哈佛和麻省理工许多生物学家纷纷投奔到政治敌意没那么浓的地方,维路奇却获得替社会大众监督科学发展的大名声。1977年,他写信给国家科学院:
在今天由赫斯特集团发行的《波士顿先驱美国人》(Boston Herald American) 上,有两则报道令我相当忧心。在马萨诸塞州多佛市,有人看到一只“怪异的橘眼生物”;在新罕布什尔州的豪利斯市(Hollis),有位男士和他的两个儿子遇到一只“九尺高的多毛生物”。
上,有两则报道令我相当忧心。在马萨诸塞州多佛市,有人看到一只“怪异的橘眼生物”;在新罕布什尔州的豪利斯市(Hollis),有位男士和他的两个儿子遇到一只“九尺高的多毛生物”。
我郑重要求贵院调查这些发现。我也希望贵院能调查这些“怪异生物”(如果真的存在的话)是否跟在新英格兰区所做的重组DNA实验有关。
尽管辩论激烈,想借由订定国家法律来规范重组DNA实验的企图,幸好一直没有成功。马萨诸塞州参议员肯尼迪(Ted Kennedy)很早就加入这场论战,在爱希勒玛会议结束后仅一个月时,就在参议院举办了一场听证会。1976年他写信给福特总统,建议联邦政府管制产业与学术界进行DNA研究。1977年3月,我到加州州议会的听证会上作证。布朗(Jerry Brown)州长也在场,我趁机建议他:除非斯坦福大学的科学家罹患不明疾病,否则不应考虑这方面的立法行动。如果那些实际处理重组DNA的人都很健康,立法者就不该把焦点放在这里,而应该去关注那些会对民众健康造成更明显威胁的事情,例如骑自行车等等,这样才能提供给民众更好的服务。

马萨诸塞州坎布里奇市的听证会,最后造成全市禁止进行重组DNA研究。中部左侧为哈佛大学的普塔什尼,下边左侧为在第二章中曾提到的梅索森。右下角为维路奇市长。—位听众高举“建立智慧,而非围堵”的标语牌。
无论是按照美国国家卫生研究院或其他国家管制单位的规定,愈来愈多的实验都显示,重组DNA程序不会制造出科学怪物(维路奇先生,对不起,可没有什么“怪异的橘眼生物”)。到了1978年,我写道:“相较于几乎其他所有以D开头的东西,DNA真的非常安全。与其用戈德堡式的图画 大肆渲染实验室里制造的DNA会导致人类的绝种,倒不如去担心匕首、炸药、狗、狄氏杀虫剂或酒醉驾驶
大肆渲染实验室里制造的DNA会导致人类的绝种,倒不如去担心匕首、炸药、狗、狄氏杀虫剂或酒醉驾驶 等的影响。”
等的影响。”
这一年不久,美国国家卫生研究院重组DNA咨询委员会(RAC)在华府提出少了许多限制的指导方针,大多数的重组研究都获得允许,可以进行,包括肿瘤病毒DNA的研究。1979年,健康、教育及福利部部长卡里法诺(Joseph Califano)同意这些修正,至此,无意义地暂缓哺乳动物癌症研究所造成的停滞时期终于结束。

漫画家笔下的重组DNA实验室,画中借用了亚当夏娃受蛇诱惑偷吃禁果的圣经故事,禁果上写着“EcoRl”(限制酶)。
其实爱希勒玛会议达成的一致决议,只不过是使重要研究延后了5年,许多年轻科学家的事业也因此中断了5年,令人沮丧。
等20世纪70年代结束时,柯恩和波耶最早的实验所引发的问题,渐渐不再是问题。虽然我们被迫绕了远路,但至少这证明了分子生物学家愿意承担社会责任。
然而,在20世纪70年代的后期,分子生物学并未因为政治因素而完全停顿。这几年中仍有一些重要进展,而且它们大多仍是以具争议的波耶-柯恩分子克隆技术为基础。最重要的突破是发明了读取DNA序列的方法。定序需要大量我们感兴趣的特定DNA片段,但是在克隆技术发展成功之前,科学家一直无法做到定序,只有一些小病毒DNA例外。如前所见,本质上,克隆即是将想要的DNA片段插入质体,再把质体插入细菌。在分裂和生长后,这些细菌会制造出大量DNA片段的复本,这时从细菌里取出DNA片段,就可进行定序。
那时候,有两种定序技术同时问世,发明人分别是马萨诸塞州坎布里奇(旧译也作“剑桥”)市哈佛大学的吉尔伯特(Wally Gilbert)和英国剑桥的桑格(Fred Sanger)。吉尔伯特从大肠杆菌的β-半乳糖苷酶基因调控系统中分离出抑制子蛋白质后,就对定序DNA产生兴趣。如前所见,他已经证明抑制子会跟基因附近的DNA结合,防止它转至RNA链上。现在他想知道那个DNA区块的序列。后来他偶然间遇到苏联杰出的化学家米尔扎别科夫(Andrei Mirzabekov),米氏建议他使用效力强大的不同化学物之组合,从特定碱基的位置切断DNA链。
吉尔伯特在华盛顿特区念高中最后一年时,经常逃课到国会图书馆去阅读物理学方面的书。后来他像所有科学神童一样,积极追寻他们心目中的“圣杯”(Holy Grail),以夺得西屋科学奖(Westinghouse Talent Search) 为目标,并在1949年顺利赢得这个奖。(后来在1980年,他接到了斯德哥尔摩瑞典学院的电话;统计数据显示,赢得西屋奖是未来赢得诺贝尔奖的最佳指标之一。)吉尔伯特在大学和研究所都专攻物理学,我在1956年抵达哈佛,一年后,他获得物理系的教职。然而当我引起他对RNA实验研究的兴趣后,他立即放弃物理学,转到我的领域。吉尔伯特思路缜密,不屈不挠,从此他一直是分子生物学的前锋。然而,就这两种定序法而言,桑格的方法比较经得起时间的考验。吉尔伯特用来切断DNA的化学物质中,有一些具有毒性,很难处理,一不小心便会危害到研究人员本身的DNA。另一方面,桑格的方法是使用在细胞里自然复制DNA的酶,亦即DNA聚合酶。他的技巧在于从已经稍微改变的碱基对中制造复本。桑格不仅使用DNA(脱氧核糖核酸)中形成的正常“脱氧碱基”(deoxy base) A,T,G,C,还加入了一些“双脱氧碱基”(dideoxy base)。双脱氧碱基有一个独特的性质:DNA聚合酶会自然而然地将它们结合至成长中的DNA链(亦即组成的复本是与称做“模板链”[template strand]的那条单股DNA互补的链),然后它就再也不能把任何碱基加入这条链。换句话说,这个复制链只能加长至双脱氧碱基为止。
为目标,并在1949年顺利赢得这个奖。(后来在1980年,他接到了斯德哥尔摩瑞典学院的电话;统计数据显示,赢得西屋奖是未来赢得诺贝尔奖的最佳指标之一。)吉尔伯特在大学和研究所都专攻物理学,我在1956年抵达哈佛,一年后,他获得物理系的教职。然而当我引起他对RNA实验研究的兴趣后,他立即放弃物理学,转到我的领域。吉尔伯特思路缜密,不屈不挠,从此他一直是分子生物学的前锋。然而,就这两种定序法而言,桑格的方法比较经得起时间的考验。吉尔伯特用来切断DNA的化学物质中,有一些具有毒性,很难处理,一不小心便会危害到研究人员本身的DNA。另一方面,桑格的方法是使用在细胞里自然复制DNA的酶,亦即DNA聚合酶。他的技巧在于从已经稍微改变的碱基对中制造复本。桑格不仅使用DNA(脱氧核糖核酸)中形成的正常“脱氧碱基”(deoxy base) A,T,G,C,还加入了一些“双脱氧碱基”(dideoxy base)。双脱氧碱基有一个独特的性质:DNA聚合酶会自然而然地将它们结合至成长中的DNA链(亦即组成的复本是与称做“模板链”[template strand]的那条单股DNA互补的链),然后它就再也不能把任何碱基加入这条链。换句话说,这个复制链只能加长至双脱氧碱基为止。
举例来说,假设现在有一个模板链,它的序列是GGCCTAGTA。在实验中,这一链有许多复本。现在我们用DNA聚合酶来复制这一链,并且事先准备好包含正常的A,T,G,C和一些双脱氧A (ddA)的混合物。这时聚合酶会开始按顺序复制,先从一个C开始(与待复制链的第一个G对应),接着依序加入C,G和G。但是等聚合酶遇到第一个T时,有两种可能:它可以把正常A加到愈来愈长的链上,也可以加入双脱氧A。如果它加入的是双脱氧A,这一链的生长到此为止,这条链会比较短,而且末端是一个双脱氧A: CCGGddA。然而,如果它刚好接上的是正常A,则它会继续加入碱基,例如T,C等等,一直要到聚合酶又遇到T时,才有机会再制造一个双脱氧“终点”。这条链会比先前那条长一点,它的序列是CCGGATCddA。每次聚合酶遇到T时(亦即要将A加入这条链时);都会有类似的情形;如果它随机选到的是正常的A,这条链会继续加长,如果它选上的是ddA,则这条链的生K到此为止。
这让我们获得什么结果?在这个实验结束时,我们可获得仵多自模板DNA复制而来、长度不一的链;它们的共同点呢?末端都是ddA。
现在假设其他三种碱基也经过相同的程序,以T为例,我们使用A,T,G,C和ddT的混合物,结果形成的分子不是CCGGAddT,就是CCGGATCAddT。
在经过四种不同的合成方式后,亦即分别加入ddA,ddT,ddG和ddC后,我们获得四组DNA链,这些链的末端分别是ddA,ddT等。现在只要我们能根据这些迷你链个别不同的长度,把它们加以分类,就可以推估出DNA链的序列。但这些迷你链的长度只是稍有差异而已,要怎么做呢?首先,我们把所有的DNA片段放在装满特殊胶体的板子上,再把这个板子放到电场里。在电场的拉力下,DNA分子被迫在凝胶中移动,特定长度的链的移动速度跟体积呈对应关系:短链的移动速度比长链快。在特定的时间范围内,最小的迷你链(比如88页的示图中用的是简单的ddC)会移动得最远,稍长的CCddG移动的距离短一点,更长的CCddG移动的距离又会短一点。现在,桑格的策略应该已经很清楚:在一定时间后,我们就可以读取这些迷你链在凝胶中的相对位置,从而推论出这个DNA片段的序列:先是C,然后再一个C,接着是G等等。
1980年,桑格、吉尔伯特和博格共同荣获诺贝尔化学奖,博格是因为改进了重组DNA技术,贡献卓著而受到嘉奖。(柯恩和波耶竟然都没有得获此殊荣,令人感到意外。)这是桑格第二次获得诺贝尔奖。 他在1958年因为发明蛋白质定序法(亦即定出其氨基酸的序列),并将它运用于人类胰岛素而第一次荣获桂冠。但是桑格的蛋白质定序法和他为DNA定序所发明的方法,毫无关联;无论是从技术或构想的角度来看,这两者之间都没有因果关系。他在发明这两种方法时,都是从头开始,他或许称得上是分子生物学早期历史上首屈一指的技术天才。
他在1958年因为发明蛋白质定序法(亦即定出其氨基酸的序列),并将它运用于人类胰岛素而第一次荣获桂冠。但是桑格的蛋白质定序法和他为DNA定序所发明的方法,毫无关联;无论是从技术或构想的角度来看,这两者之间都没有因果关系。他在发明这两种方法时,都是从头开始,他或许称得上是分子生物学早期历史上首屈一指的技术天才。
桑格不像是你心目中的诺贝尔奖双料得主。他出生于贵格派基督教家庭,在第二次世界大战期间,他是社会主义者,曾经拒服兵役。更罕见的是,他从不宣扬自己的成就,宁可把自己获得诺贝尔奖的证据藏起来:“得到一个不错的金牌,就放在银行保险箱里;得到一张证书,就放在阁楼里。”他甚至曾拒绝接受爵士爵位:“爵位会让你与众不同,对吧?但我并不想与众不同。”退休后,桑格以照顾剑桥市郊自宅的花园为乐,偶尔也会到“桑格中心”走走,但总是保持低调。桑格中心成立于1993年,位于剑桥附近,是专门从事基因组定序的机构。
桑格的DNA定序法

新DNA股的混合物,每股的长度不一,末端都是加有标记的双脱氧碱基。在凝胶中被电场分离的DNA产物,从胶体底端往上读就是新DNA股的序列。
定序确认为20世纪70年代最了不起的发现之一。我们已经知道基因是由A,T,G和C构成的线状链,而且这些碱基是根据遗传密码每次三个三个地转译的,进而创造出由氨基酸构成的长链,亦即蛋白质。但是罗伯兹(Richard Roberts)和夏普(Phil Sharp)等人的杰出研究都显示,其实在许多生物体中,基因是以一段段的方式存在的,重要的编码DNA之间穿插着许多不相干的DNA片断。惟有在转录信使RNA之后,“编辑”过程才会把不相干的部分切除掉。这就像本书中突然跑出一段显然随机插入的无关段落,例如棒球或罗马帝国史。吉尔伯特将这些横插一脚的序列称为“插入序列”(intron),而真正负责蛋白质编码的序列(亦即基因具有实际功能的部分)则称为“表现序列”(exon)。后来发现,插入序列主要是复杂的生物体的特色,像细菌就没有插入序列。有些基因的插入序列特别多,例如在人体内,凝血第八因子的基因(血友病患者的这种基因可能发生了突变)有25段插入序列。凝血第八因子是很大的蛋白质,大约有2000个氨基酸那么长,但是为它编码的表现序列仅占基因总长的4%而已,其余96%都是插入序列。

序列大师吉尔伯特(左)和桑格。
既然如此,插入序列的存在理由是什么?它们的存在显然会使细胞过程变得极度复杂,因为必须先把它们删掉才能形成信使RNA。这个编辑过程很棘手,特别是从信使RNA中切除一段插入序列时,例如在切除凝血第八因子的信使RNA时发生错误,就有可能会造成移码突变,进而使形成的蛋白质毫无用处。有个理论认为插入序列只是退化的结果,也就是地球上早期生物在进化后所遗留下来的残余物。但是对于为何会有插入基因,以及它们对伟大的生命密码有何用途,至今仍是经常争论的议题。
一旦我们发现真核生物(eukaryote,指细胞内有专供储存遗传物质的细胞核的生物)基因的普遍性质后,立刻掀起了一股科学淘金热。一批批拥有尖端技术装备的科学家竞相成为分离(克隆)出重要基因和找出其特色的第一人。最早期的宝藏之一就是造成哺乳动物罹患癌症的突变基因。只要完成数种经过彻底研究的肿瘤病毒(例如SV40)的DNA定序,就可以明确指出致癌基因。这些基因能把正常细胞变成具有癌症特质的细胞,例如生长失控和有细胞分裂倾向,最后造成肿瘤。没多久,分子生物学家就开始分离出人类癌细胞的基因,最后证实人类的癌症起因于DNA的变化,而不是像先前所想的,只是单纯、意外、无关基因的不正常增生而已。我们发现了会加速或促成癌生长的基因,也发现了会减缓或阻止癌生长的基因。细胞似乎就像一辆汽车,需要兼具油门和刹车才能正常运作。
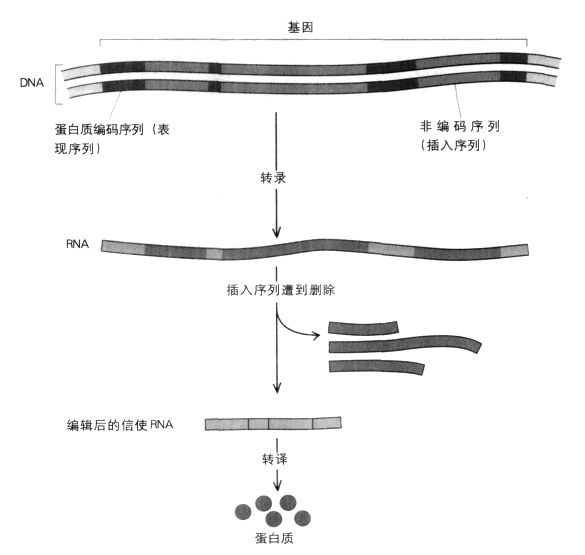
插入序列和表现序列:在制造蛋白质前,信使RNA中不负责编码的插入序列会被删除。
基因寻宝游戏席卷整个分子生物学界。1981年,冷泉港实验室开了一门进阶夏季课程,教导基因克隆技术。其后三年中,此课程的实验室手册《分子克隆》(Molecular Cloning)销售了8万本。DNA革命的第一阶段(1953—1972),也就是早期发现双螺旋和遗传密码所引起的兴奋,最终使得大约3000名科学家投入这个领域。第二阶段从重组DNA和DNA定序技术开始,但在10年多一点的时间内,这个领域的人数就暴增了100倍。
人数增加也创造出一个全新的产业:生物技术(biotechnology)。1975年后,关切DNA的人不再仅限于想了解生命分子基础的生物学家。分子不再是身穿白色实验袍的科学家擅长的学术领域,它已经进入一个截然不同的世界,而这个世界里的人大半穿着时髦西装,打着真丝领带。克里克把他在剑桥的家取名为“黄金双螺旋”(Golden Helix),如今这个名字也有了全新的意义。
此处clone指的是针对殖入细菌细胞的一段特定DNA,制造出多重拷贝(复本)。clone这个词之所以令人混淆,是因为它也指复制整个动物,其中最著名的就是经无性繁殖而产生的复制羊“多利”。在第一个用法中,我们复制的只是DNA的一个片段:但在第二个用法中,我们复制的是整组基因。
古典遗传学也谈“重组”,因此“重组DNA”一词可能造成一些混淆。在孟德尔定律的遗传学中,重组是指染色体的分裂与重新组成,最后形成的是染色体片段混合与配对的结果。在现代的分子遗传学中,“混合与配对”是把两段DNA重新组合至单一的合成分子内,规模小得多。
现在的《波士顿先驱报》(Boston Herald)之前身。
戈德堡(Rube Goldberg,1883-1970),美国著名漫画家,擅长画无比复杂但其实只是解决极简单问题的机器。——译者注
匕首等词的英文全是以D开头。——译者注
1998年,在旧经济时代转变为新经济时代后,西屋奖更名为英特尔奖(Intel Prize)。
有些杰出人士跟桑格一样是诺贝尔奖双料得主。居里夫人获物理奖(1903)和化学奖(1911);巴丁(John Bardeen)因发现电晶体(1956)和超导性(1972)两次获得物理奖;泡令先获化学奖(1954),再获和平奖(1962)。